Magnesio, calcio, sodio… ¿qué elemento sustituirá al litio en las baterías?
Lo principal es entender el mecanismo de reacción y el funcionamiento de estos posibles candidatos a sustituir a las baterías de litio como son el sodio y el magnesio

Los sistemas de almacenamiento de energía eléctrica respetuosos con el planeta, con alta densidad de energía y con una mayor seguridad son extremadamente necesarios para la sociedad.
Las baterías de iones de litio muestran una gran competitividad como sistemas de almacenamiento de energía. Se usan a escala mundial para alimentar dispositivos electrónicos, herramientas eléctricas, drones y vehículos eléctricos e híbridos debido a su elevada densidad de energía y potencia, larga vida útil y benignidad ambiental.
Sin embargo, el elevado coste de estos dispositivos, los problemas de seguridad, la baja abundancia y distribución geográfica desigual de los recursos de litio en la corteza terrestre limitan su desarrollo.

A lo largo de los últimos años, la comunidad científica se ha volcado en la búsqueda de sistemas electroquímicos que empleen elementos alternativos al litio. Entre ellos podemos destacar el sodio, potasio, magnesio, calcio, aluminio y zinc.
Los candidatos
El sodio y el potasio (iones alcalinos) se consideran dos de los mejores candidatos para sustituir al litio debido a que presentan propiedades análogas, como un elevado potencial reductor.
Alternativamente, iones alcalinotérreos como el magnesio son más abundantes en la corteza terrestre. Además, podrían aportar una mayor seguridad y vida útil a las baterías, ya que previenen el crecimiento de fibras de metal o dendritas (depósitos que afectan a la vida útil de las baterías y pueden ocasionar cortocircuitos).
La reacción redox de un ion multivalente estaría a priori vinculada a la transferencia de múltiples electrones durante el proceso de carga y descarga. Por lo tanto, las baterías de iones multivalentes podrían aportar una mayor densidad de energía.
Principales desventajas
Estas nuevas baterías recargables aún presentan varios desafíos, como una velocidad lenta, poca reversibilidad, baja capacidad específica, etc.
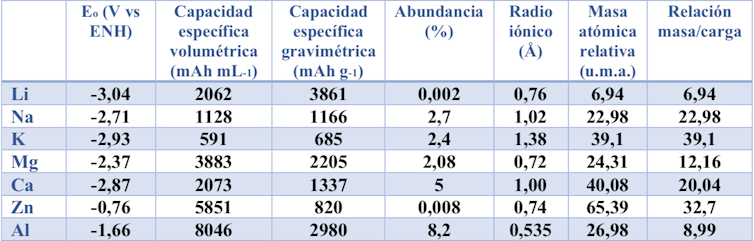
- Iones multivalentes. Debido a su fuerte unión a la estructura de los sólidos, suelen presentar una velocidad de difusión lenta, por lo que la falta de materiales catódicos adecuados es uno de los desafíos para construir baterías recargables.
- Iones alcalinos (sodio y potasio). Su mayor peso atómico, potencial algo menos reductor y radio iónico más elevado (ver tabla) podrían limitar la capacidad específica, la densidad de energía, el rendimiento durante el proceso de carga y descarga o incluso la vida útil de la batería, debido a una pérdida continua de la capacidad.
- Baterías de magnesio. Presentan inconvenientes como la escasez de electrolitos que sean compatibles con el ánodo de magnesio metal, así como la formación de una capa de desechos de la descomposición del electrolito en la superficie del ánodo metálico que impide su funcionamiento.
- Baterías de calcio. Su desarrollo se ve obstaculizado por la incompatibilidad entre electrodos y electrolitos y por la generación de una lámina de residuos que bloquea la difusión de los iones calcio.
- Baterías acuosas de iones de cinc. La actual baja capacidad de descarga y corta vida útil de las baterías basadas en iones multivalentes imponen restricciones en su desarrollo. El cinc siempre está sujeto a graves problemas de pérdidas de capacidad durante la carga y la descarga. Se debe a la formación de dendritas y a problemas debidos a la corrosión de este metal y el elevado carácter polarizante del ion.
- Baterías de iones de aluminio. Las propiedades electroquímicas de carga y descarga aún no se han mejorado. Son obstáculos importantes las reacciones secundarias entre el electrolito y el cátodo, la inestabilidad del voltaje durante los procesos de carga, el bajo voltaje de descarga y la deficiente estabilidad estructural de los materiales del cátodo.
Por tanto, las opciones más prometedoras de cara al futuro son las baterías de iones de sodio, las baterías de iones de magnesio y las baterías multiión.
Baterías de iones de sodio
El sodio es el elemento alcalino más cercano al litio en la tabla periódica. Por tanto, tiene una naturaleza similar y un comportamiento parecido en el almacenamiento de energía electroquímica. También presenta otras ventajas como su alta abundancia, reducido coste y bajo impacto ambiental.
Sin embargo, las baterías recargables basadas en sodio tienen algunos inconvenientes:
- Falta de materiales catódicos adecuados.
- Inferior voltaje de trabajo.
- Menor capacidad específica con respecto al litio.
- Al igual que en las baterías de iones de litio, las análogas de iones de sodio también presentan problemas de seguridad.
Baterías de iones de magnesio
El magnesio presenta un bajo coste y es un material más seguro y respetuoso con el medio ambiente que el litio.
Cuando se usa como ánodo, el magnesio tiene un potencial de electrodo menos reductor que el litio, pero consigue una velocidad rápida al depositarse o redisolverse, sin pérdidas del elemento durante los ciclos. No forma dendritas, lo que hace que sea un material muy seguro.
En comparación con el ánodo de litio, el de magnesio es capaz de ofrecer una mayor capacidad debido a su naturaleza divalente.
La investigación en baterías de iones de magnesio está acaparando un gran interés en los últimos años. A pesar de ello, su aplicación práctica aún se enfrenta a grandes desafíos debido, principalmente, a la falta de materiales catódicos de voltaje suficientemente alto que puedan proporcionar una buena velocidad de inserción y extracción de los iones de magnesio.
Baterías multiion
Las baterías multiion presentan propiedades interfaciales por estudiar. Además, en este tipo de sistemas, los procesos de carga y descarga involucran el transporte de múltiples iones entre el electrolito y los electrodos. Esto hace que el comportamiento de estas baterías esté fuertemente influenciado por la formación y estabilidad de la capa superficial, que influye en la difusión de cada tipo de ion entre el electrolito y el electrodo.

Limitaciones y perspectivas de futuro
El desarrollo de estos posibles candidatos todavía presenta algunas limitaciones:
- Comprensión incompleta del mecanismo de reacción de los iones multivalentes. Debido al gran tamaño y/o alta densidad de carga, los iones alternativos al litio generalmente consiguen velocidades bajas cuando se mueven a través de la red anfitrión. De ahí la prioridad de conocer su mecanismo de reacción.
- Bajo voltaje de trabajo y efectos secundarios indeseables. Es indispensable un diseño sofisticado de la batería para aumentar el voltaje de funcionamiento. Debido a la diferente naturaleza electroquímica de los distintos iones, la existencia de cationes múltiples en el electrolito podría provocar algunos efectos secundarios indeseables en la reacción redox de los electrodos.
- Falta de seguridad en la evaluación de las baterías multiion. La seguridad es un importante indicador para determinar si estos acumuladores pueden tener aplicaciones a nivel comercial. Hasta el momento, hay poca información de su seguridad en la literatura, por lo que está sería otra línea a investigar en el futuro.
De momento, lo principal es entender el mecanismo de reacción y el funcionamiento de estos posibles candidatos a sustituir a las baterías de litio como son el sodio y el magnesio. Estos materiales ya han demostrado ser prometedores y podrían tener aplicabilidad en baterías para vehículos eléctricos, dispositivos móviles y sistemas de almacenamiento de energía eólica y fotovoltaica.
Recientemente, hemos desarrollado una batería alternativa de magnesio que emplea un fosfato de vanadio y cromo –el Na₃VCr(PO₄)₃– como cátodo para incrementar su potencial de reacción.
Dicho compuesto es especialmente prometedor debido a su alta densidad de energía y estructura estable. Por primera vez, hemos comprobado su utilidad en baterías con ánodo de magnesio y de multiion de magnesio y sodio con ánodo de carbono activado.![]()
Este artículo fue publicado originalmente en The Conversation. Lea el original.
![]()

