Las mujeres tienen un sistema inmune más robusto, pero eso puede pasarles factura
El sexo contribuye a crear diferencias fisiológicas y anatómicas que influyen en la exposición, reconocimiento, eliminación y transmisión de microorganismos

Shutterstock.
Una cueva en cualquier lugar de Europa, África o Asia hace unos 100.000 o 200.000 años. Grupos de unos treinta Homo sapiens se refugian en cavernas donde tratan de mantener el fuego encendido permanentemente, para protegerse del frío y de los animales. Durante aquellos tiempos, las principales causas de muerte eran accidentes de caza, infecciones o desastres naturales. En el caso de las mujeres, debían añadirse las complicaciones durante un parto.
El Neolítico, caldo de cultivo para las infecciones
Hace unos 10.000 años, con la revolución agrícola, se desarrollan asentamientos y, posteriormente, aldeas y ciudades de hasta miles de habitantes. En estas urbes premodernas se hacinan familias con múltiples hijos, animales, basura, restos orgánicos… y todo ello sin sistemas de limpieza ni alcantarillado.
Surge así un gran caldo de cultivo para la transmisión de infecciones persona-persona o animal-persona, bien por contacto directo o por vía aérea a través de los aerosoles y gotas respiratorias.
Entonces, las causas de muerte predominantes eran, pues, las epidemias producidas por agentes patógenos altamente contagiosos: gripe, viruela, neumonías, tuberculosis, cólera, tifus, sarampión, polio, peste… Y así ha sido durante miles de años, tanto en adultos como en niños. Incluso ahora, el 69% de la mortalidad de niños de menos de cinco años se debe a las infecciones.
En este contexto, no sería de extrañar que aquellas mujeres y sus descendientes contaran con unas defensas más potentes y tuvieran mayor probabilidad de supervivencia, gracias a la selección natural darwiniana de los más aptos. Así se favorecería la reproducción de la especie.
Mejor preparadas frente al VIH, los tumores malignos, la covid…
Pero ¿es realmente el sistema inmune femenino más robusto? El sexo viene definido por las características cromosómicas, órganos reproductivos y niveles de hormonas esteroideas del individuo. Es distinto al género, que incluye comportamientos y actividades determinadas por la sociedad.
El sexo contribuye a crear diferencias fisiológicas y anatómicas que influyen en la exposición, reconocimiento, eliminación y transmisión de microorganismos. Por su parte, el género puede reflejar comportamientos que influyen en la exposición a microorganismos y el acceso a sistemas de salud.
De cualquier forma, algunos hechos confirman la distinta respuesta inmune en mujeres:
- En infecciones agudas por VIH, el virus alcanza una carga viral 40% menor en las pacientes femeninas que en los hombres.
- Los varones tienen el doble de probabilidades de fallecer por tumores malignos.
- Las respuestas a vacunas como la gripe son al menos dos veces más potentes en mujeres.
- La mortalidad por covid-19 en las primeras olas fue muy superior en los hombres frente a las pacientes femeninas, a pesar de presentar cifras similares de carga viral.
La otra cara de la moneda
En general, las mujeres adultas producen una respuesta inmune innata y adaptativa más intensa que los varones. Esto permite una eliminación más rápida de microbios, una mayor eficacia de las vacunas… pero también acarrea una mayor susceptibilidad a las enfermedades autoinmunes: el 80% de estas patologías les afectan a ellas.
Entre las enfermedades autoinmunes más frecuentes en el sexo femenino, nos encontramos con las siguientes:
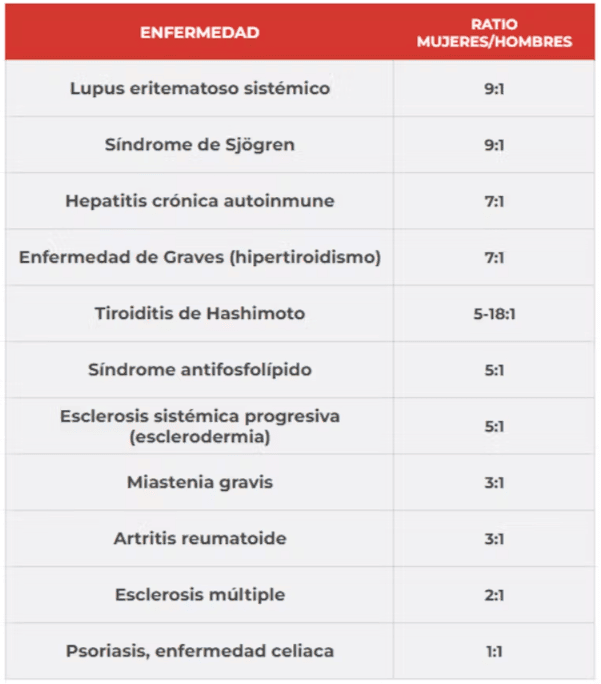
¿Y a qué se debe esta incidencia tan desigual? Varios mecanismos fisiológicos pueden explicarlo:
- Diferencias en las hormonas sexuales. Los estrógenos, la progesterona y la prolactina (hormonas sexuales femeninas) parecen aumentar la actividad del sistema inmune, mientras que los andrógenos (hormonas sexuales masculinas) podrían disminuirla.
- Inactivación anormal del cromosoma X, responsable de la síntesis de múltiples proteínas implicadas en la respuesta inmune. En las mujeres, que tienen dotación cromosómica XX, uno de estos cromosomas es “silenciado” de forma aleatoria en las primeras fases embrionarias. Pero un 15 % de sus genes podrían escapar a esta desactivación, lo que se ha relacionado con la aparición de linfocitos autorreactivos y de algunas enfermedades autoinmunes.
- Interacción de las bacterias intestinales con determinadas células inmunes. Esta podría alterar el desarrollo normal de tejidos linfoides y modular así el sistema inmune.
- Factores ambientales, como uso de cosméticos o exposición al sol.
- Mayores niveles de anticuerpos y de autoanticuerpos, es decir, anticuerpos dirigidos contra células y tejidos del propio organismo.
A más anticuerpos, más enfermedades autoinmunes
A colación de este último punto, varios datos sugieren efectivamente una relación causal entre el aumento de anticuerpos y la aparición de enfermedades autoinmunes, que ha sido observada no solo en mujeres, sino también en varones con síndrome de Klinefelter (con un cromosoma X extra, es decir, XXY).
Concretamente, el posparto es un momento en el que se incrementan tanto los niveles de anticuerpos como la aparición de dolencias autoinmunes o brotes de estas. Además, parece existir una asociación entre el número de hijos y el riesgo de sufrir algunas patologías como la artritis reumatoide y las tiroiditis autoinmunes.
Otro hecho que respalda este vínculo es que la administración de rituximab, un tratamiento biológico para bloquear los linfocitos B productores de anticuerpos, parece retrasar la aparición de artritis reumatoide en pacientes predispuestas.
Y, por último, los propios estrógenos aumentan la producción de anticuerpos por los linfocitos.
Por tanto, la selección natural darwiniana habría potenciado cualquier mecanismo que reduzca el riesgo de infecciones en las madres y sus hijos, y entre ellos, una mayor respuesta inmune. Sin embargo, esto conlleva la contrapartida de aumentar el riesgo de padecer enfermedades autoinmunes.
Este artículo fue publicado originalmente en The Conversation. Lea el original.

