Un equipo científico resucita los ancestros de la herramienta de edición genética CRISPR Cas
Un equipo liderado por españoles ha comprobado que estos sistemas arcaicos revitalizados son más versátiles que las versiones actuales
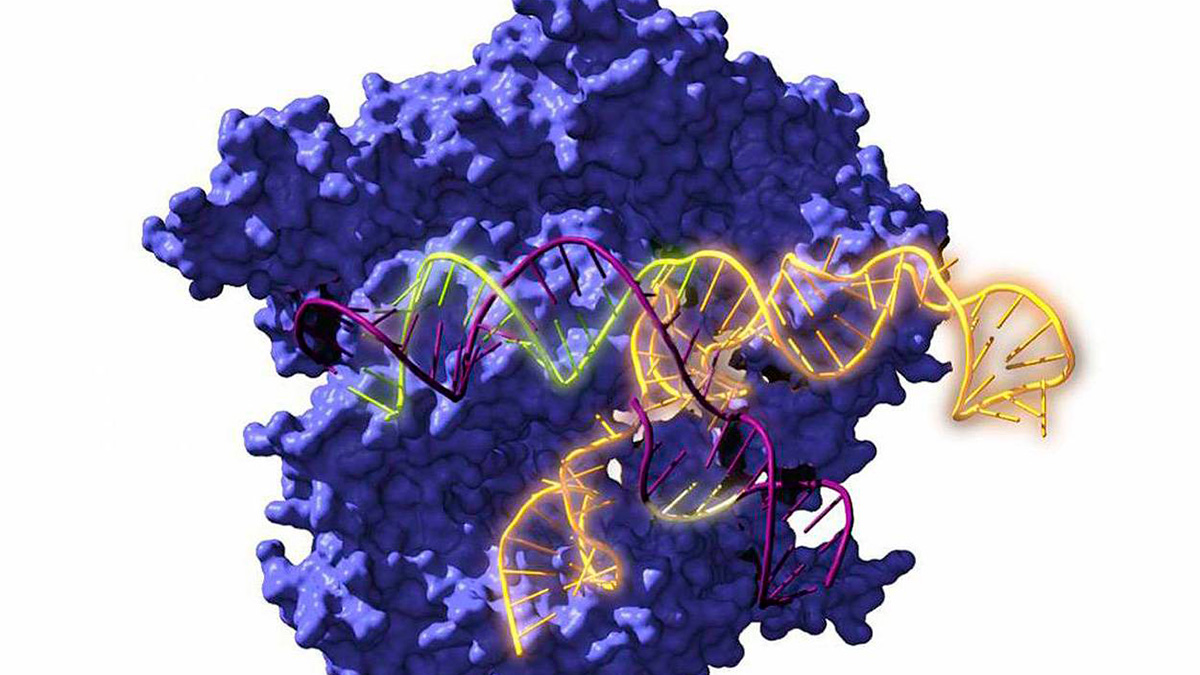
Imagen de Cas9, una enzima endonucleasa asociada con el sistema CRISPR, actuando sobre el ADN objetivo. | Antonio Reifs (CIC nanoGUNE)
Un grupo de investigación internacional ha reconstruido por primera vez ancestros del conocido sistema CRISPR Cas de hace 2.600 millones de años y ha estudiado su evolución a lo largo del tiempo. Los resultados, publicados en la revista Nature Microbiology, apuntan a que los sistemas revitalizados no solo funcionan, sino que son más versátiles que las versiones actuales y podrían tener «aplicaciones revolucionarias» en la edición genética y tratamiento de enfermedades, señalan los autores.
En el proyecto, dirigido por el investigador Ikerbasque de CIC nanoGUNE Rául Pérez-Jiménez, participan equipos del CSIC, la Universidad de Alicante, el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y otras instituciones estatales e internacionales,
El acrónimo CRISPR es el nombre de unas secuencias repetitivas presentes en el ADN de bacterias y arqueas (organismos procariotas). Entre las repeticiones, estos microorganismos albergan fragmentos de material genético de virus que han infectado a sus antepasados, lo que les permiten reconocer si se repite la infección y defenderse cortando el ADN de los invasores mediante proteínas Cas asociadas a estas repeticiones.
Las tijeras moleculares CRISPR Cas permiten hoy en día cortar y pegar trozos de material genético en cualquier célula, lo cual hace posible su utilización para editar el ADN.
Los esfuerzos de investigación actuales se centran en encontrar nuevas versiones de sistemas CRISPR Cas con propiedades distintas en los lugares más recónditos del planeta
Los esfuerzos de investigación actuales se centran en encontrar nuevas versiones de sistemas CRISPR Cas con propiedades distintas en los lugares más recónditos del planeta. Para esto, se exploran sistemas de diferentes especies que habitan en entornos extremos o se aplican técnicas de diseño molecular para modificarlos. Una forma radicalmente diferente de encontrar nuevos sistemas es buscarlos en el pasado, que es precisamente la base de esta investigación.
Reconstrucciones de proteínas y genes de organismos extintos
El grupo de Nanobiotecnología de nanoGUNE, liderado por Raúl Pérez-Jiménez, lleva años estudiando la evolución de las proteínas desde el origen de la vida hasta nuestros días. Realizan reconstrucciones ancestrales de proteínas y genes de organismos extintos para observar qué cualidades tienen y si son utilizables en aplicaciones biotecnológicas.
Es un viaje en el tiempo llevado a cabo por medio de técnicas bioinformáticas. En el nuevo trabajo han logrado reconstruir por primera vez la historia evolutiva de los sistemas CRISPR Cas, desde ancestros de hace 2.600 millones de años hasta la actualidad.
El equipo de investigación ha realizado la reconstrucción informática de las secuencias CRISPR ancestrales, las ha sintetizado y ha estudiado y confirmado su funcionalidad.
«Resulta sorprendente que podamos revitalizar proteínas Cas que debieron existir hace miles de millones de años y constatar que ya tenían entonces la capacidad de operar como herramientas de edición genética, algo que hemos confirmado en la actualidad editando con éxito genes en células humanas» explica Lluís Montoliu, investigador del Centro Nacional de Biotecnología del CSIC (CNB-CSIC) y del CIBERER, y responsable del grupo que ha validado funcionalmente estas Cas ancestrales en células humanas en cultivo.
«Resulta sorprendente que podamos revitalizar proteínas Cas que debieron existir hace miles de millones de años y constatar que ya tenían entonces la capacidad de operar como herramientas de edición genética»
Lluís Montoliu, investigador del CNB
Aplicaciones nuevas con sistemas arcaicos
Otra interesante conclusión del estudio es que el sistema CRISPR Cas ha ido haciéndose más complejo a lo largo del tiempo, lo cual es una señal del carácter adaptativo del mismo, ya que ha ido amoldándose a las nuevas amenazas de virus que las bacterias han sufrido a lo largo de la evolución.
«Esta investigación supone un extraordinario avance en el conocimiento sobre el origen y evolución de los sistemas CRISPR Cas. En cómo la presión selectiva de los virus ha ido puliendo a lo largo de miles de millones de años una maquinaria rudimentaria, poco selectiva en sus inicios, hasta convertirla en un sofisticado mecanismo de defensa capaz de distinguir con gran precisión el material genético de invasores indeseados que debe destruir, de su propio ADN que debe preservar», añade el investigador de la Universidad de Alicante y descubridor de la técnica CRISPR Cas, Francis Mojica.
En la vertiente aplicada, «el trabajo representa una forma original de abordar el desarrollo de herramientas CRISPR para generar nuevos instrumentos y mejorar las derivadas de los existentes en organismos actuales», añade Mojica.
«Los sistemas actuales son muy complejos y están adaptados para funcionar dentro de una bacteria. Cuando el sistema se utiliza fuera de ese entorno, por ejemplo, en células humanas, el sistema inmune provoca un rechazo y existen además determinadas restricciones moleculares que limitan su uso. Curiosamente, en los sistemas ancestrales algunas de estas restricciones desaparecen, lo que les confiere una mayor versatilidad para nuevas aplicaciones», recalca Pérez-Jiménez.
Por su parte, Miguel Angel Moreno, jefe del servicio de Genética del Hospital Ramón y Cajal e investigador del CIBERER, apunta que «la ingenuidad que podía tener una nucleasa ancestral, en cuanto a que no reconoce tan específicamente algunas regiones del genoma, la convierte en una herramienta más versátil para corregir mutaciones que hasta ahora eran no editables o se corregían de manera poco eficiente».
Su grupo ha desarrollado la herramienta, que ha permitido caracterizar, mediante secuenciación masiva y análisis bioinformático, el efecto de la edición del genoma producido por Cas ancestrales en células humanas en cultivo.
«Este logro hace posible disponer de herramientas de edición genética con propiedades distintas a las actuales, más flexibles, lo que abre nuevas vías en la manipulación de ADN y tratamiento de enfermedades»
Ylenia Jabalera, investigadora del proyecto en nanoGUNE
Ylenia Jabalera, investigadora del proyecto en nanoGUNE, sostiene que «este logro científico hace posible disponer de herramientas de edición genética con propiedades distintas a las actuales, mucho más flexibles, lo cual abre nuevas vías en la manipulación de ADN y tratamiento de enfermedades, tales como ELA, cáncer y diabetes, o incluso como herramienta de diagnóstico».
Referencia:
Alonso-Lerma, B. et al. “Evolution of CRISPR-associated Endonucleases as Inferred from Resurrected Proteins”. Nature Microbiology (2022).

