El tejido testicular congelado sigue siendo viable después de dos décadas
Los resultados de un estudio en ratas, llevado a cabo en EEUU, podrían tener importantes implicaciones en el tratamiento de niños con cáncer
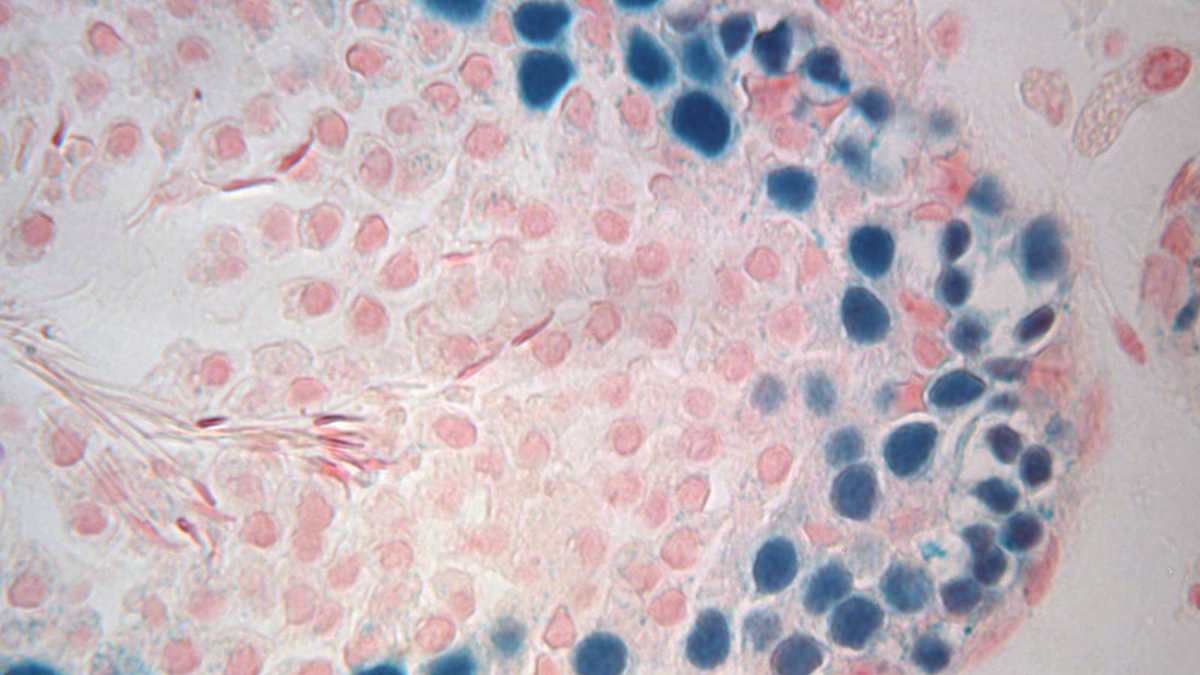
Sección transversal de un testículo de ratón infértil que muestra células germinales y espermatozoides de rata previamente congelados. | Eoin Whelan et al.
El tejido testicular masculino criopreservado puede reimplantarse después de más de 20 años y seguir produciendo espermatozoides viables, según un nuevo estudio en roedores, publicado esta semana en PLOS Biology.
Sin embargo, el trabajo liderado por Eoin Whelan, de la Facultad de Medicina Veterinaria de la Universidad de Pensilvania (EEUU), señala que el largo retraso tiene un coste en la reducción de la fertilidad en comparación con el tejido que solo se congela brevemente.
Según Whelan, «los resultados pueden tener importantes implicaciones en el tratamiento de niños con cáncer, para los que la quimioterapia puede ir precedida de la recogida y congelación de tejido de sus testículos para una eventual reimplantación».
La tasa de supervivencia de los cánceres infantiles ha aumentado en las últimas décadas, pero un efecto secundario grave del tratamiento es la disminución de la fertilidad futura.
Un posible tratamiento consistiría en recoger, congelar y reimplantar tejido de los testículos, que contiene células madre, un procedimiento demostrado recientemente en un modelo de macaco que restablece la fertilidad, al menos tras una congelación de corta duración.
Pero en el caso de los niños prepúberes con cáncer, el reimplante puede no ser factible hasta una década o más después de la extracción, lo que plantea la cuestión de cuánto tiempo pueden permanecer viables las células madre espermatogénicas congeladas.
Células criopreservadas durante 23 años
Para explorar esta cuestión, los autores descongelaron este tipo de células madre de rata que habían sido criopreservadas en su laboratorio durante más de 23 años, y las implantaron en las llamados ratones ‘desnudos’, que carecen de una respuesta inmunitaria que de otro modo rechazaría el tejido extraño.
Luego, compararon la capacidad de las células madre espermatogénicas congeladas durante mucho tiempo para generar esperma viable con aquellas criopreservadas durante solo unos meses y con las recién recolectadas, todas ellas procedentes de una única colonia de ratas mantenida durante varias décadas.
Los autores descubrieron que las células madre espermatogénicas congeladas eran capaces de colonizar los testículos de los roedores y generar todos los tipos de células necesarias para producir espermatozoides con éxito, pero no con tanta fuerza como las células de las muestras de tejido recogidas más recientemente.
Aunque las células congeladas durante mucho tiempo presentaban perfiles similares de cambios en la expresión génica en comparación con las otras muestras, produjeron menos espermátidas alargadas, que pasan a formar espermatozoides nadadores.
Una buena noticia
Los resultados ponen de relieve la importancia de realizar pruebas in situ de la viabilidad de las células madre espermatogénicas, en lugar de basarse en biomarcadores bioquímicos o celulares, para determinar el potencial de las células criopreservadas, que puede no reflejar la pérdida real del potencial de estas células con el paso del tiempo.
La buena noticia, señala Whelan, «es que esta viabilidad no se pierde durante la congelación a largo plazo, lo que indica que puede ser posible identificar y mitigar los factores clave de la pérdida de viabilidad con el fin de mejorar las opciones reproductivas de los niños tratados por cánceres infantiles».

